Mario Gomes-Pereira (voire sa page personnelle), chargé de recherche INSERM, équipe Repeat Expansions & Myotonic Dystrophy (REDs) dirigée par Denis Furling et Geneviève Gourdon.
Quel est l’objectif général de ce projet ?
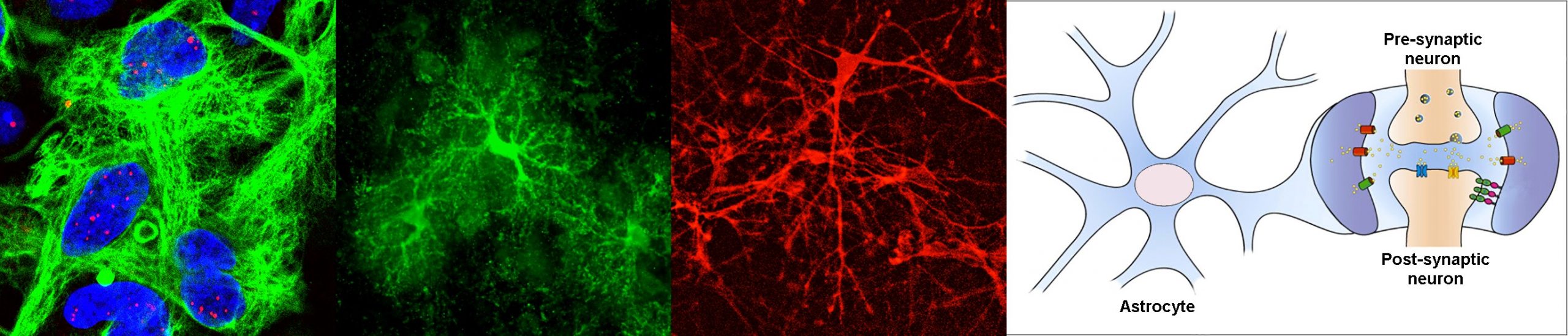
La dystrophie myotonique de type 1, ou DM1, est une maladie neuromusculaire qui touche 1/8000 personnes dans le monde, mais ce chiffre est probablement sous-estimé. Bien que mieux connue pour ses manifestations musculaires, il s’agit d’un désordre multisystémique qui se caractérise par une atteinte neurologique très importante. La mutation DM1, une amplification d’un trinucléotide répété, a été identifiée en 1992, et aujourd’hui, nous en savons beaucoup sur la pathogenèse moléculaire dans les cellules musculaires. En revanche, nous savons encore peu de choses sur les mécanismes de la maladie dans le système nerveux central. Ce projet découle de notre hypothèse selon laquelle la DM1 a un fort impact sur les cellules gliales, avec des conséquences sur la physiologie neuronale et le fonctionnement du cerveau. Nous étudierons spécifiquement les mécanismes et les conséquences du dysfonctionnement des astrocytes dans DM1, avec Cyril F. Bourgeois (ENS, Lyon), Cécile Martinat (I-Stem, Evry) et Nathalie Rouach (Collège de France, Paris).
Pourquoi avez-vous décidé d’étudier le rôle des astrocytes dans DM1 ?
Lorsque j’ai rejoint le groupe de Geneviève Gourdon, nous avons établi un nouvel axe de recherche pour répondre au besoin urgent de comprendre les mécanismes des maladies cérébrales dans le DM1. Je suis aujourd’hui responsable de cette ligne de recherche, que je gère depuis 15 ans. Nous nous sommes d’abord concentrés sur la cible la plus évidente, les neurones, et nous avons trouvé des anomalies dans un nombre de protéines synaptiques [Brain (2013), 136: 957, DOI: 10.1093/brain/aws367]. Cependant, nous sommes également tombés, de façon inattendue, sur des anomalies prononcées dans les astrocytes, ce qui a fourni la première preuve de pathologie gliale [Cell Reports (2017) 19: 2718, DOI: 10.1016/j.celrep.2017.06.00; Frontiers in Cellular Neuroscience (2021), 15: 662035, DOI: 10.3389/fncel.2021.662035]. Nous avons été très intrigués par ces résultats surprenants et avons décidé de concentrer notre attention sur les astrocytes. Ainsi, nous avons démontré que la morphologie, l’adhésion, l’orientation et la migration des astrocytes sont affectées dans la DM1. Ces résultats, récemment publiés dans Nature Communications, ont clairement déplacé la vision neurocentrique de la DM1, vers une composante non-neuronale [Nature Communications (2022) 13: 3141. DOI : 10.1038/s41467-022-31594-9]. Le projet ASTROMYOD a pour objectif de disséquer davantage les mécanismes moléculaires derrière la pathologie des astrocytes dans la DM1, et son impact fonctionnel sur l’intégralité de la fonction cérébrale.
À quelles questions spécifiques allez-vous répondre et comment allez-vous y répondre?
Les perturbations de l’homéostasie de l’ARN sont impliquées dans plusieurs maladies humaines, pour lesquelles la DM1 est devenu le prototype. La pathogenèse moléculaire de la DM1 résulte de l’accumulation nucléaire des molécules d’ARN toxique, ce qui perturbe principalement l’activité d’importantes protéines de liaison à l’ARN, telles que la famille MBNL des régulateurs d’épissage. Les protéines MBNL jouent une pléthore de rôles dans le traitement de l’ARN, y compris la régulation de l’épissage alternatif, la polyadénylation et la localisation intracellulaire des transcrits. Ces mécanismes sont essentiels pour la dynamique fonctionnelle des cellules hautement ramifiées et compartimentées du cerveau, comme les astrocytes. Dans ce projet, nous étudierons l’impact des altérations des protéines MBNL1 sur la fonction astrocytaire dans la DM1, et comment ces anomalies conduisent à un dysfonctionnement du cerveau. Pour cela, nous analyserons la pathogenèse cérébrale par des techniques de transcriptomique, bio-informatique et imagerie à haute résolution. Grâce à des modèles murins transgéniques uniques de DM1, ainsi que dans des cellules souches et organoïdes pluripotents humains, nous allons élucider les mécanismes à l’origine de l’atteinte cérébrale de la DM1.
Comment le consortium de recherche a-t-il été constitué?
L’étude intégrative des mécanismes moléculaires et cellulaires des maladies cérébrales nécessite une approche multidisciplinaire. Ce projet réunit quatre partenaires ayant une expertise complémentaire dans la pathogenèse et les modèles animaux de la DM1 (M. Gomes-Pereira); la bio-informatique de l’épissage et de l’expression des gènes (C.F. Bourgeois); les modèles humains de cellules souches pluripotentes et d’organoïdes (C. Martinat); la biologie des cellules astrocytaires, l’électrophysiologie et le comportement de la souris (N. Rouach). Ce n’est pas la première fois que nous collaborons. Lorsque j’ai décidé pour la première fois d’étudier les astrocytes dans le DM1, j’ai contacté les autres partenaires. Nous travaillons ensemble depuis 5 ans. Nous avons déjà obtenu un financement de l’ANR pour démontrer pour la première fois les défauts de l’astroglie dans DM1, et nous avons publié ensemble dans le passé, avec d’autres manuscrits actuellement en préparation. Cela s’est avéré être une collaboration très réussie et passionnante. Je suis heureux que nous disposions aujourd’hui des moyens financiers d’aller plus loin dans l’aventure.
Quel est l’impact attendu de votre projet ?
Les manifestations neuropsychologiques de la DM1 sont très débilitantes. Elles se traduisent par des problèmes d’apprentissage à l’école chez les jeunes patients, ainsi qu’une mauvaise intégration professionnelle et socio-économique plus tard dans la vie. La compréhension de la pathogenèse cérébrale est une priorité pour le développement de thérapies efficaces. L’implication des cellules gliales dans la DM1 façonnera la conception de futures thérapies. Pour améliorer les déficits cognitifs et comportementaux dans la DM1, la correction des défauts neuronaux ne suffira pas à elle seule. Il sera important de développer des outils thérapeutiques qui ciblent également les astrocytes, et très probablement d’autres cellules non neuronales. Grâce à l’identification des voies moléculaires perturbées dans le DM1 et au développement de nouveaux modèles murins et de cellules humaines, nous établirons des bases et des outils puissants pour répondre aux besoins thérapeutiques urgents de cette maladie. Enfin, nos résultats révéleront des aspects importants de la biologie de l’ARN dans les cellules du cerveau.