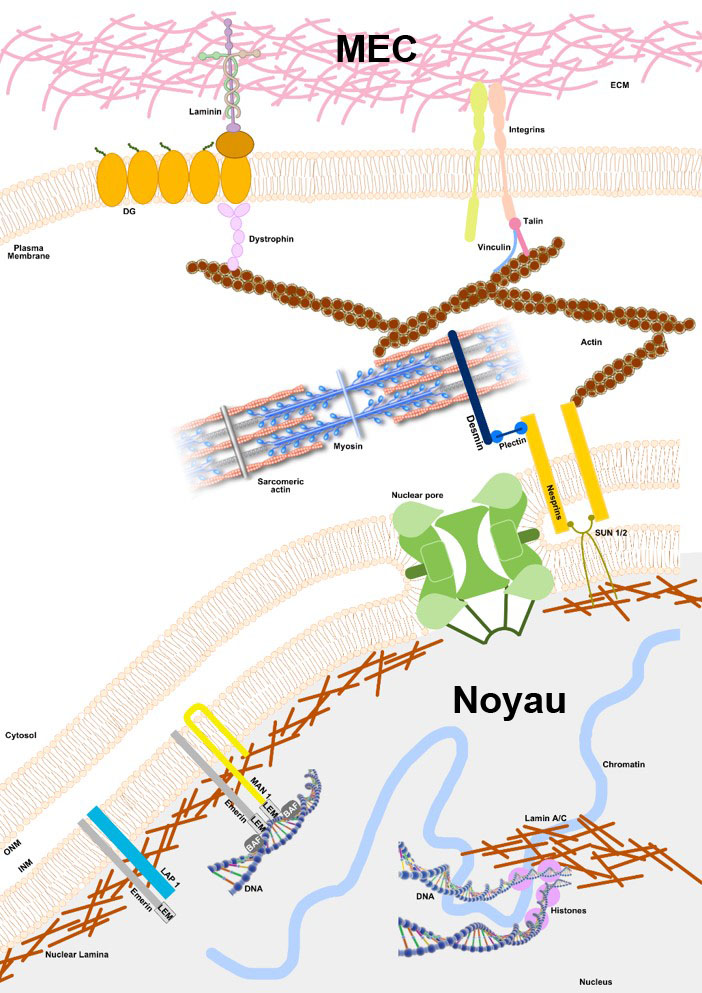
Equipe BONNE / ALLAMAND
Génétique et physiopathologie des MNM liées à la matrice extracellulaire et du noyau
Les thèmes de recherche de l’équipe se concentrent sur 2 groupes de maladies neuromusculaires (MNM) : les myopathies dues aux anomalies de la Myomatrice et du Myonucleus dues aux mutations du gène LMNA codant pour des lamines de type A ou des gènes codant pour des composants liés à la membrane nucléaire

Equipe BITOUN / VASSILOPOULOS
Organisation de la cellule musculaire et thérapie de la myopathie centronucléaire autosomique dominante
Renforcer les connaissances sur des aspects fondamentaux de la biologie du muscle est un défi pour comprendre les maladies affectant ce tissu et pour identifier de nouvelles cibles d’intervention thérapeutique. C’est l’objectif de notre équipe au travers de l’étude de la mécanotransduction, des connections cytosquelette-enveloppe nucléaire, de la machinerie d’endocytose et du devenir des vecteurs viraux adéno-associés dans le muscle sain et pathologique. Notre ambition est également de mieux caractériser le groupe des myopathies congénitales et d’apporter une solution thérapeutique aux patients atteints de la forme dominante de la myopathie centronucléaire.
Equipe TROLLET/MOULY
Orchestration cellulaire et moléculaire en régénération musculaire, pendant le vieillissement et en pathologies
L’équipe s’intéresse aux acteurs moléculaires et cellulaires impliqués chez l’homme dans la régénération musculaire, lors du vieillissement musculaire et dans les dystrophies musculaires, particulièrement la dystrophie musculaire oculo-pharyngée (OPMD) et la dystrophie musculaire de Duchenne (DMD).
Equipe FURLING/GOURDON
Repeat Expansions & Myotonic Dystrophy (REDs)
La thématique de recherche de l’équipe, a visée translationnelle, est centrée sur la physiopathologie de la Dystrophie Myotonique (DM1) ou maladie de Steinert causée par une expansion instable de répétitions CTG, ainsi que sur le développement et l’évaluation de thérapies pour cette maladie neuromusculaire.
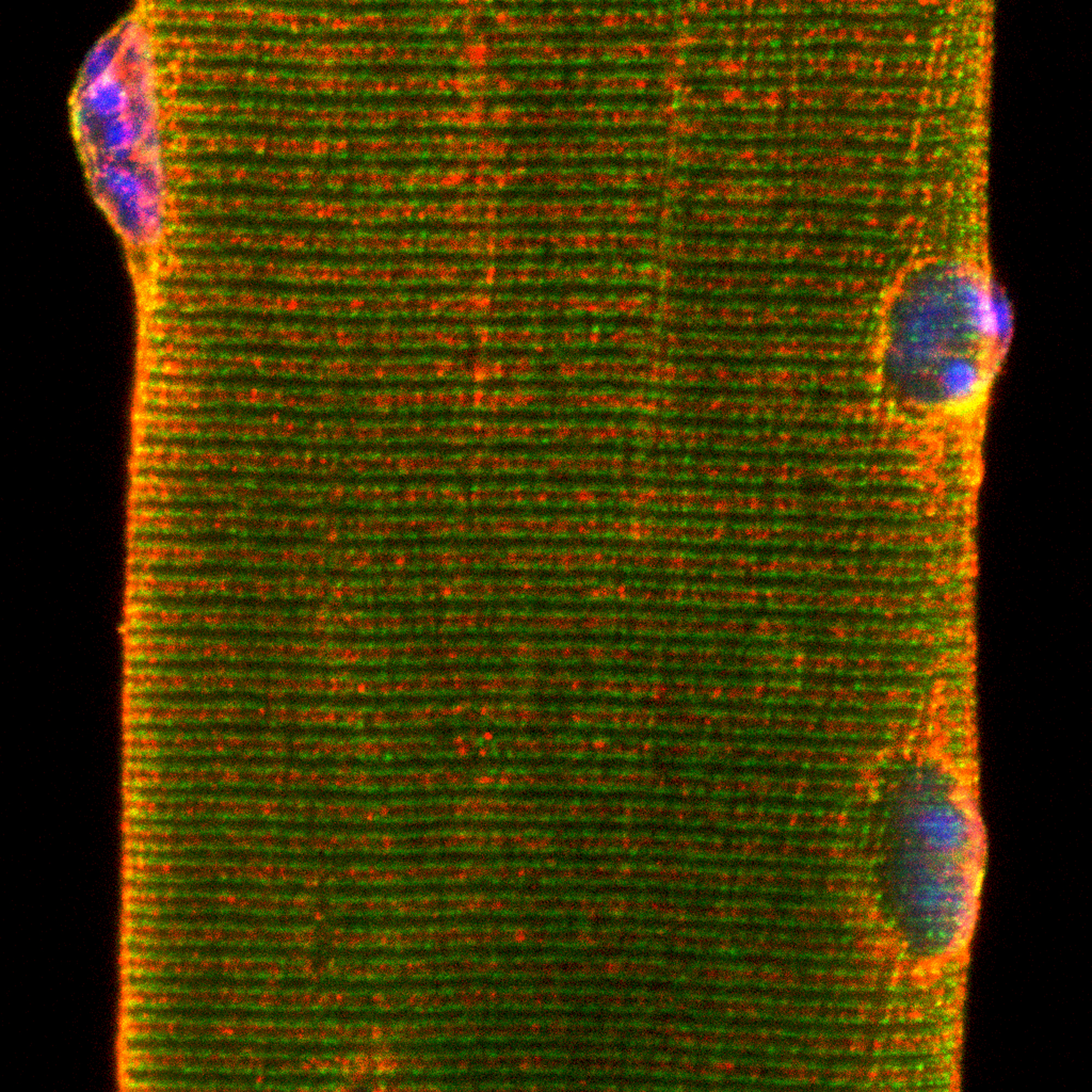
Equipe PIETRI-ROUXEL
Thérapie génique pour la DMD & physiopathologie du muscle squelettique
Décrypter les mécanismes qui régissent la plasticité du muscle squelettique est essentiel pour comprendre les processus physiopathologiques liés aux maladies neuromusculaires et au vieillissement (sarcopénie) et ainsi optimiser les stratégies thérapeutiques.
Notre équipe s’intéresse à l’optimisation des approches thérapeutiques pour traiter la Dystrophie musculaire de Duchenne (DMD) grâce à un traitement combiné pour renforcer de manière significative l’effet à long terme du traitement par thérapie génique. Actuellement, nous évaluons ce traitement combiné par injection systémique dans un modèle murin de DMD très sévère qui souffre de symptômes graves et progressifs : perte des fonctions motrices, atteinte des fonctions cardiaques et diaphragmes et mort prématurée, imitant la physiopathologie des patients atteints de DMD. Nous décryptons également les mécanismes de maintien de la masse musculaire. En effet, comme la fonte musculaire squelettique exacerbe la morbidité et la mortalité de plusieurs pathologies, l’identification et la caractérisation des traitements à base de la protéine GDF5 qui favorise le maintien de la masse musculaire et la contractilité peuvent être cruciales pour améliorer la qualité de vie et optimiser les thérapies pour les maladies musculaires. Ainsi, nous étudions les mécanismes moléculaires qui régissent le rôle du GDF5 et évaluons son utilisation thérapeutique dans le contexte des maladies neuromusculaires mais également au cours du vieillissement, la Sarcopénie.
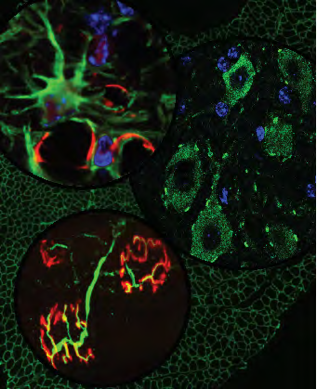
Equipe SMERIGLIO
Biothérapies des maladies du motoneurone (SLA & SMA)
L’objectif principal de notre équipe est d’identifier des stratégies efficaces pour le transfert de gène dans le système nerveux central (SNC) et ainsi développer de nouvelles thérapies pour les maladies du motoneurone. L’amyotrophie spinale (SMA) et la sclérose latérale amyotrophique (SLA) sont deux pathologies encore incurables.
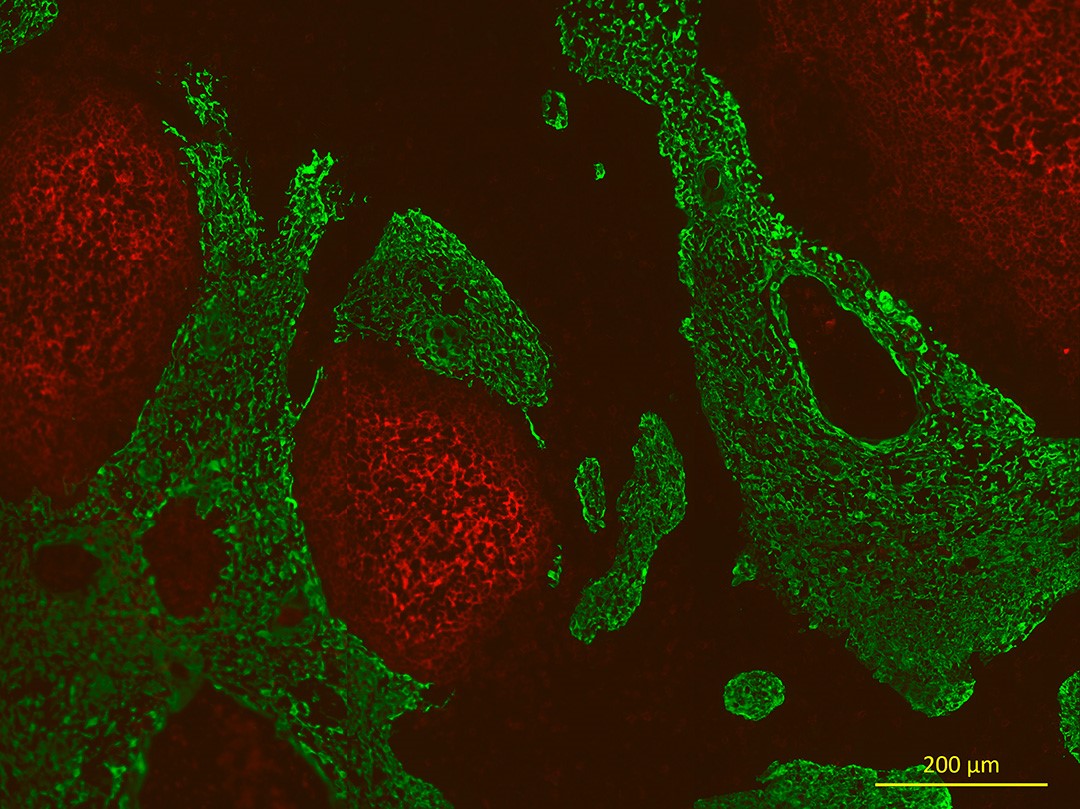
Equipe LE PANSE
Myasthenia Gravis: étiologie, physiopathologie & approche thérapeutique
La myasthénie auto-immune est une maladie complexe liée à la production d’auto-anticorps ciblant la jonction neuromusculaire. L’équipe s’intéresse aux mécanismes étiologiques et physiopathologiques impliqués dans la myasthénie en étudiant notamment les dysfonctionnements du système immunitaire et l’implication du thymus.
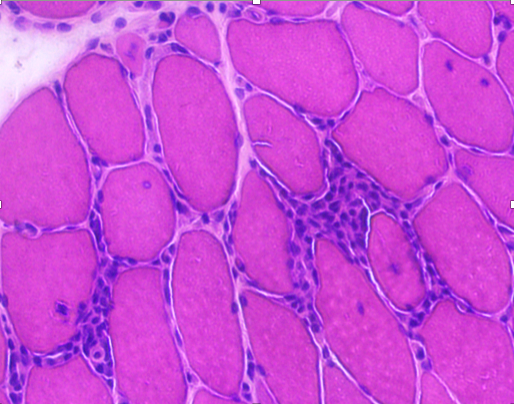
Equipe BENVENISTE
Myopathies inflammatoires & thérapies innovantes ciblées
L’équipe est fortement impliquée dans les études de médecine translationnelle ciblées sur l’immunologie du muscle (des myopathies inflammatoires primaires (myosites) aux réactions immunitaires provoquées par les immunothérapies du cancer.
Equipe MUCHIR
Voies de signalisation & muscles striés
Les muscles striés comptent pour à peu près 40% du poids total du corps, contiennent 50 à 75% des protéines totales du corps et contribuent signifi-cativement à de multiples fonctions corporelles. Il existe deux types de muscles striés : les muscles squelet-tiques et le muscle cardiaque.