Connectivité neuromusculaire en santé & pathologies
Notre équipe s’intéresse aux mécanismes cellulaires et moléculaires qui sous-tendent l’assemblage et la maintenance de la synapse neuromusculaire en condition physiologique et pathologique.
La jonction neuromusculaire (JNM) est la zone de contact qui s’établie entre les motoneurones et les fibres musculaires qu’ils innervent. Cette synapse est responsable de l’initiation et du contrôle du mouvement. Par conséquent, une grande partie de notre comportement et de notre bien-être repose sur le fonctionnement approprié de cette structure spécialisée. Un dysfonctionnement de la transmission neuromusculaire survient dans un large éventail de maladies rares humaines, notamment les canalopathies, la myasthénie congénitale ou acquise et la sclérose latérale amyotrophique. La plupart de ces pathologies sont incurables et mettent la vie en danger, avec des conséquences économiques et sociales dévastatrices en termes de perte de qualité de vie et de fardeau de l’invalidité. Les patients présentent des phénotypes cliniques complexes principalement caractérisés par une faiblesse musculaire et une perte de mobilité.
Nous utilisons un large éventail d’essais fonctionnels comprenant l’imagerie morphologique quantitative, l’analyse comportementale et l’électrophysiologie à l’aide de modèles murins et / ou de spécimens dérivés de l’homme, afin d’explorer la complexité des mécanismes de communication intercellulaire contrôlant la connectivité neuromusculaire. Notre objectif principal est d’améliorer les connaissances physiopathologiques pouvant être utilisées non seulement pour le diagnostic moléculaire et le conseil génétique des familles touchées par les pathologies que nous étudions, mais également pour la conception de nouvelles cibles présentant un intérêt thérapeutique.
Pour atteindre cet objectif, notre équipe s’appuie sur une organisation qui favorise les interactions étroites entre les neurologues du Centre de référence Paris Est des pathologies neuromusculaire et les chercheurs / assistants de recherche, ainsi que sur un vaste réseau de collaborations nationales / internationales pour partager connaissances et compétences.
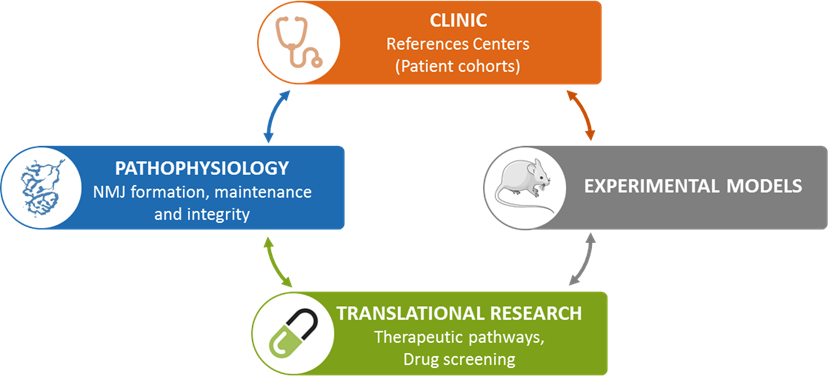
Nous avons défini trois objectifs principaux de recherche:
1) Caractériser les déterminants moléculaires sous-jacents à l’assemblage et à la maintenance de la JNM (PI: Laure Strochlic / Julien Messéant)
Nous avons récemment identifié une nouvelle voie de communication à la JNM et développé des outils innovants utilisant la génétique de la souris pour disséquer ses caractéristiques moléculaires.
2) Comprendre comment la perturbation de la communication nerf / muscle conduit à des maladies neuromusculaires telles que la myasthénie et la sclérose latérale amyotrophique (PI: Stéphanie Godard-Bauché / Gaelle Bruneteau)
Grâce à notre expertise clinique et nos réseaux nationaux, nous analysons les mécanismes physiopathologiques sous-jacents aux maladies étudiées chez les patients.
3) Moduler la communication trans-synaptique pour rétablir une connectivité synaptique appropriée dans un contexte pathologique comme base d’interventions thérapeutiques (PI: Bertrand Fontaine / Laure Strochlic)
Nous développons des stratégies pharmacologiques ou génétiques innovantes qui favorisent la communication trans-synaptique à la JNM afin d’atténuer les symptômes de la maladie dans le but de prévenir ou de compenser la progression de la perte de fonction motrice dans les maladies neuromusculaires.
Mots clés: Jonction neuromusculaire, Troubles neuromusculaires, modèles murins de modélisation de la maladie, spécimens dérivés de l’homme, imagerie quantitative, stratégies thérapeutiques.
Collaborations Principales :
- Rozen Le Panse et Sonia Berrih-Aknin (France)
- Arnaud Ferry (France)
- Cécile Martinat (France)
- Eric Krejci (France)
- Frédérique Charbonnier (France)
- Nathalie Sans (France)
- Laurent Schaeffer (France)
- Hanns Lochmüller (Canada)
- Markus Ruëgg (Switzerland)
| Nom | Position | ORCID |
|---|
- M Boex, J Messéant, S Bauché, B Fontaine, L Strochlic. Role of Vangl2, a core component of the Wnt Planar cell Polarity pathway during neuromuscular junction formation. 15th International Congress on Neuromuscular Diseases, 2018, Vienne (Autriche), Austria. ⟨hal-04002728⟩
- Élodie Martin, Majid Amar, Carine Dalle, Ihsen Youssef, Céline Boucher, et al.. New role of P2X7 receptor in an Alzheimer's disease mouse model. Molecular Psychiatry, In press, ⟨10.1038/s41380-018-0108-3⟩. ⟨hal-01900819⟩
- Strochlic Laure. Regulation of neuromuscular connectivity by Wnt signaling. Regulation of neuromuscular connectivEMBO Workshop on Molecular mechanisms of muscle wasting during aging and disease, 2018, Ascona, Switzerland. ⟨hal-04002986⟩
- Hugo Poulin, Pascal Gosselin-Badaroudine, Savine Vicart, Karima Habbout, Damien Sternberg, et al.. Substitutions of the S4DIV R2 residue (R1451) in NaV1.4 lead to complex forms of paramyotonia congenita and periodic paralyses. Scientific Reports, 2018, 8, pp.2041. ⟨10.1038/s41598-018-20468-0⟩. ⟨hal-01717643⟩
- Yosuke Kokunai, Carine Dalle, Savine Vicart, Damien Sternberg, Valérie Pouliot, et al.. A204E mutation in Nav1.4 DIS3 exerts gain- and loss-of-function effects that lead to periodic paralysis combining hyper- with hypo-kalaemic signs. Scientific Reports, 2018, 8, pp.16681. ⟨10.1038/s41598-018-34750-8⟩. ⟨hal-01922467⟩
- Stéphanie Bauché, Geoffroy Vellieux, Damien Sternberg, Marie-Joséphine Fontenille, Guy Brochier, et al.. Mutations in GFPT1-related congenital myasthenic syndromes are associated with synaptic morphological defects and underlie a tubular aggregates myopathy with synaptopathy. journées de la société française de myologie, Nov 2017, Colmar, France. ⟨hal-03994005⟩
- Elisa Teyssou, Laura Chartier, Maria-Del-Mar Amador, Roselina Lam, Géraldine Lautrette, et al.. Novel UBQLN2 mutations linked to Amyotrophic Lateral Sclerosis and atypical Hereditary Spastic Paraplegia phenotype through defective HSP70-mediated proteolysis. Neurobiology of Aging, 2017, 58, pp.239.e11-239.e20. ⟨10.1016/j.neurobiolaging.2017.06.018⟩. ⟨hal-03001781⟩
- Sophie Nicole, Yoshiteru Azuma, Stéphanie Bauché, Bruno Eymard, Hanns Lochmuller, et al.. Congenital Myasthenic Syndromes or Inherited Disorders of Neuromuscular Transmission: Recent Discoveries and Open Questions. Journal of Neuromuscular Diseases, 2017, 4 (4), pp.269-284. ⟨10.3233/JND-170257⟩. ⟨hal-01653365⟩
- Julien Messéant, Jérôme Ezan, Perrine Delers, Konstantin Glebov, Carmen Marchiol, et al.. Wnt proteins contribute to neuromuscular junction formation through distinct signaling pathways. Development (Cambridge, England), 2017, 144 (9), pp.1712 - 1724. ⟨10.1242/dev.146167⟩. ⟨hal-01542853⟩
- Stéphanie Bauché, Geoffroy Vellieux, Damien Sternberg, Marie-Joséphine Fontenille, Elodie de Bruyckere, et al.. Mutations in GFPT1-related congenital myasthenic syndromes are associated with synaptic morphological defects and underlie a tubular aggregate myopathy with synaptopathy. Journal of Neurology, 2017, 264 (8), pp.1791-1803. ⟨10.1007/s00415-017-8569-x⟩. ⟨hal-01653176⟩